Der fatale Abbau unseres Gehirns: Warum sich im Gehirn Demenz entwickelt und was die neuen Medikamente bedeuten
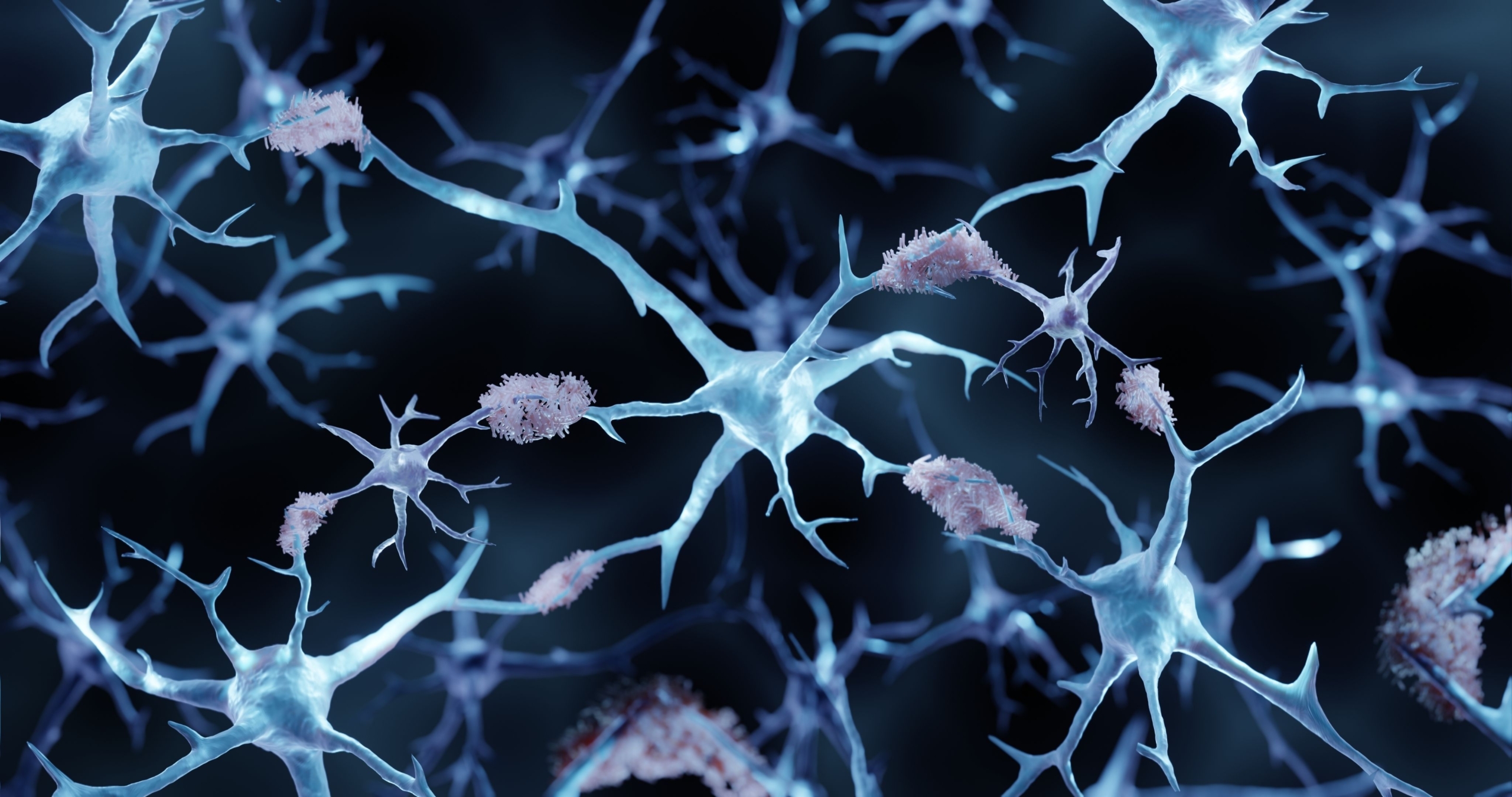
Amyloid und Tau heissen die Akteure des bösen Spiels. Proteine, die zu Eiweissablagerungen im Gehirn führen und damit zur Demenzerkrankung Alzheimer. Diese beiden Proteinablagerungen sieht man bei allen geschädigten Gehirnen von Alzheimer-Patienten. «Unser Gehirn ist wie ein grosser Ozean und in diesem fangen diese Eiweissablagerungen an, Inseln zu bilden», sagt der Neurologe Ansgar Felbecker, Präsident der Swiss Memory Clinics.
Das Eiweiss Amyloid befindet sich vorwiegend ausserhalb der Gehirnzellen, das Tau im Innern. Beide führen dazu, dass die Hirnzellen auf diesen Inseln mit der Zeit absterben. Leider nehmen diese Inseln der Eiweissablagerungen immer mehr Platz ein, bis sich eine grosse zusammenhängende Fläche im Gehirn ergibt. Irgendwann ist dann das ganze Hirn befallen.
Zuvor sind es nur einzelne Regionen, weshalb sich die Symptome bei Alzheimer-Patienten langsam einschleichen. «Bei den einen betrifft es zuerst die Sprachregion, bei anderen die visuelle Erkennung, wieder bei anderen eher der Antrieb. Alle Funktionen, die unser Hirn ausmachen, können von der Demenz betroffen sein», sagt der Leitende Arzt an der Klinik für Neurologie am Kantonsspital St.Gallen.
In welcher Hirnregion die Demenz beginnt, ist unterschiedlich und zufällig. Es gibt aber Orte, wo sie besonders häufig anfängt. Bei der typischen Altersdemenz beginnt es meistens in der Gedächtnisstruktur, dem Hippocampus. Das ist sozusagen ein Arbeitsspeicher, ähnlich wie beim Computer. Zusätzlich ist auch der Scheitellappen eine typische Anfangsregion: Assoziationsfelder, in denen man von einem Gedanken auf den nächsten kommt. Bei jüngeren Alzheimer-Patienten stimmt das aber oft nicht, da kann Alzheimer auch in anderen Hirnregionen beginnen.
Hohes Demenzrisiko bei über 80-Jährigen

Peter Ruggle
Felbecker hält allerdings fest, dass Alzheimer grundsätzlich eine Alterserkrankung ist. Mit dem hohen Alter steigt das Risiko deutlich: Über 80-Jährige haben ein Risiko von 10 bis 12 Prozent, über 90-Jährige von 40 Prozent. Mit der erwarteten Überalterung der Gesellschaft könnte Alzheimer somit zu einer Volkskrankheit werden. Heute sind 150’000 Menschen in der Schweiz von Demenz betroffen, davon 100’000 an Alzheimer. Bei den anderen 50’000 Alzheimer-Patienten sind Durchblutungsstörungen nach einem Schlaganfall oder chronischen Durchblutungsstörungen die häufigste Ursache.
Alois Alzheimer hatte die Krankheit im Jahr 1906 an einer Modellpatientin beschreiben. Bereits er erkannte die beiden Proteinablagerungen. Noch heute ist allerdings unbekannt, ob das Protein Amyloid oder Tau am Anfang der Alzheimer-Erkrankung stehen. «Da gibt es zwei grosse Glaubenslager in der Forscherszene», sagt Felbecker. Lange hat man geglaubt, dass sich das Amyloid zuerst festsetzt und Tau als Folge davon. Deshalb hat man für die Behandlung von Alzheimer vorwiegend das Protein Amyloid erforscht. Aber nicht nur deswegen: Heute versucht man mit Antikörpern, das Protein anzugreifen und zu binden und dann aus dem Körper zu entfernen. Das gelingt mit Amyloid viel einfacher als mit Tau. Zwar gibt es auch Forschungsversuche, die auf Tau zielen, die sind aber noch weit weg vom klinischen Alltag.
Allerdings zeigen die Studien der letzten Jahre mit Amyloid nur einen mässigen Erfolg, deshalb mehren sich die Stimmen, dass Tau eine wichtigere Rolle spielen könnte. Die Reihenfolge bleibt unklar, auch weil das in einem gesunden Gehirn schwierig zu untersuchen ist. Wer lässt sich freiwillig eine Probe aus seinem Hirn entnehmen, um dieser Frage auf den Grund zu gehen? Zudem müsste man Menschen finden, die ganz am Anfang der Demenzerkrankung stehen. Sie müssten relativ jung sein, weil die Eiweissablagerungen 15 bis 20 Jahre vor den ersten Symptomen beginnen. Das Rätsel ist ungelöst, die Forschung setzt daher primär auf Amyloid.
Auch das neuste Alzheimer-Medikament Lecanemab der Unternehmen Biogen und Eisai zielt auf Amyloid. Diesem neuen Hoffnungsträger wurde in diesen Tagen eine Zulassung der amerikanischen Arzneimittelbehörde FDA erteilt. Wenige ernste Nebenwirkungen wurden in den Studien der klinischen Phase-III-Studie festgestellt. Die Studienergebnisse zeigen, dass Lecanemab in einem sehr frühen Krankheitsstadium die Eiweissablagerungen signifikant reduziert und ebenfalls den kognitiven Abbau, also die Fähigkeiten für Alltagsaktivitäten, verlangsamt. Die Erwartungshaltung in der Alzheimer-Community sei riesig, sagt Felbecker, «weil es seit 20 Jahren keine Neuentwicklung mehr gegeben hat, die beim Patienten angekommen ist». Das Medikament habe Beachtung verdient und auch, dass man dieses auch in der Schweiz bei Patienten ausprobiere.
Fortschreiten der Demenz nur minimal verlangsamt
Die Messlatte dürfe man allerdings nicht zu hoch ansetzen, weil man in den klinischen Studien zwar gesehen habe, dass Lecanemab das Amyloid weitgehend aus dem Hirn entfernt, aber das Fortschreiten der Demenz wurde nur minimal verlangsamt. Konkret könnten die Ergebnisse aber bedeuten, dass ein Alzheimer-Patient dank Lecanemab vielleicht ein Jahr länger soziale Kontakte pflegen, das Telefon besser bedienen kann oder in der Küche länger zurechtkommt. Für zukünftige Therapien wäre es aber anstrebenswert, wenn Patienten im Frühstadium mit einem Medikament behandelt werden, das die Erkrankung ganz stoppt. Dann könnten Menschen länger in Normalität leben. Euphorie sei wegen Lecanemab deshalb nicht angebracht, «aber es ist besser als alles, was in den letzten Jahren gekommen ist».

Imago
Weil die Neuronen wegen Alzheimer im Gehirn absterben, wird es nie ein Medikament geben, dass totale Erholung bewirken könnte. Aber das menschliche Gehirn hat die Fähigkeit, viel zu kompensieren. Wenn man es schafft, den Prozess zu stoppen, könnte sich das für den einzelnen Patienten wie eine Heilung anfühlen, die er zusätzlich durch Rehatraining unterstützen kann. Eine komplette Heilung versprechen sich manche von dem Einsatz von Stammzellen, mit denen man schon heute in Leber und Herz Zellen wieder nachbauen kann. Das Gehirn ist von der Funktionalität her aber viel komplexer, Stammzellentherapien zur Alzheimer-Behandlung hält Felbecker deshalb für ausgeschlossen.
Nicht für gänzlich ausgeschlossen hält der Präsident der Swiss Memory Clinics dagegen eine Impfung gegen die Demenz. Aber Impfungen macht man per Definition an gesunden Menschen, deshalb muss sie immer sicher und wirksam sein. Wo Wirkung ist, besteht auch das Risiko von Nebenwirkungen, was bei einer Hirnimpfung heikel ist. Deshalb ist eine Impfung noch weit entfernt, auch wenn diese technisch heute wohl möglich wäre, um Amyloidablagerungen zu verhindern. Ist das Sterberisiko dabei zu hoch, wird die Impfung auch gegen eine solche gefürchtete Erkrankung wie Alzheimer keine Chance haben. Neue Möglichkeiten könnte dabei vielleicht die mRNA-Technologie bieten. Zumindest bei den Therapien wird bereits mit der mRNA-Technik geforscht, um Tauablagerungen zu blockieren.
Noch offen ist die Preisfrage bei Lecanemab: Die Firma Biogen hatte zuvor bereits ein anderes Alzheimer-Medikament in der Pipeline. Doch das Medikament Aducanumab ist gescheitert. Zum einen waren die Effekte weniger gut als bei Lecanemab. Zum anderen hat sich Aducanumab nicht durchgesetzt, weil die Firma in den USA einen überrissenen Preis dafür verlangt hat. Zugelassen ist es nur in den USA, in Europa und der Schweiz wird darauf verzichtet. So wartet man gespannt auf die Kosten für Lecanemab, die wahrscheinlich auch hoch sein könnten.
Am besten wäre eine Kombination von Amyloid- und Tautherapie, aber die Entwicklungszyklen für eine neue Therapie sind immer sehr lang. «Man hat in der Forschung dabei rückblickend auch Fehler gemacht. Da hat man gesehen, dass ein Angriff mit dem Wirkstoff an der falschen Stelle zu fatalen Nebenwirkungen führen kann. Zum Beispiel hat es im Jahr 2000 im Rahmen von Alzheimer-Impfstudien auch Tote gegeben wegen Hirnentzündungen», sagt Felbecker. Auch die Nebenwirkungen einer Kombinationsbehandlung von Amyloid und Tau sind unklar.